Acinetobacter baumannii
Acinetobacter baumannii bakterio patogeno oportunista gram negatiboa da. Gaur egun, mundu mailan ezagutzen den infekzio nosokomialen eragile bakteriano nagusienetakoa da; antibiotikoekiko erakusten duen erresistentzia handiagatik. Ospitaleetan bere hazkuntza errazago azaltzen da, eta oraindik ez da infekzioaren tratamendu eraginkorrik aurkitu. Hargatik, azken urteotan asko ikerturiko mikroorganismoa da.[1]
| Acinetobacter baumannii | |
|---|---|
 | |
| Sailkapen zientifikoa | |
| Erreinua | Pseudomonadati |
| Filuma | Pseudomonadota |
| Klasea | Gammaproteobacteria |
| Ordena | Pseudomonadales |
| Familia | Moraxellaceae |
| Generoa | Acinetobacter |
| Espeziea | Acinetobacter baumannii [[Philippe Bouvet, Patrick Grimont|]], 1986 |
| Datu orokorrak | |
| Gram tindaketa | bakterio gram-negatibo |
Iraqibacter izen arruntez ere ezagutzen da, Irak-eko militarren zainketa guneetan mikroorganismoak izaniko hedapena dela eta.[2]
Historia aldatu
Mikroorganismoa lehenengo aldiz isolatu zenean (Beijerinck,1911) “Micrococcus calco-aceticus” gisa sailkatu zen. 43 urte behar izan ziren Acinetobacter generoaren baitan sartzeko (Brisou and Prevot, 1954). DNA-DNA hibridazio bidez (Bouvet and Grimnot, 1986) eginiko ikerketak jarraituz, egun Acinetobacter generoaren barruan 26 espezie daude (bederatzi espezie genomiko). Horietatik lau (A.calcoaceticus, A.baumannii, Acinetobacter 3 eta 13 TU espezie genomikoak) fenotipikoki oso antzekoak dira, desberdintzeko zailak eta ACB (Acinetobacter calcoaceticus baumannii) konplexuaren baitan sailkatzen dira. [3]
Morfologia aldatu
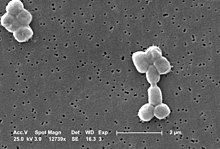
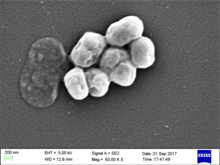
Acinetobacter baumannii kokobaziloa dela esaten da, baina bakterio pleomorfikoa da, hau da, bizi-zikloan zehar, etapa ezberdinetan forma ezberdina erakusten du. Fase geldikorrean aurkitzen denean, koko itxura nabariagoa erakusten du, eta askotan, taldeka agertzen da. Acinetobacter baumanni-ren fase geldikorra. Koko itxura eta taldekaturik Hazkuntza-fasean daudenean, 1,5-2,5 eta 1-1,5 μm bitartean neurtzen dute, eta jada kokobazilo itxura nabarmentzen da.[4]
Ekologia aldatu
Acinetobacter generoko espezie guztiak ingurune guztietan bizi daitezkeela uste da, hainbat ur eta lur laginen aurrean erresistentzia erakutsi dutelako. A.baumannii ordea, ia esklusiboki ospitaleetako inguruneetatik isolatu da eta bere habitat natural zehatza ezezaguna da oraindik.
Mikroorganismoa, batik bat ehun hezeetan aurkitu da, hala nola, mukosan, edo agerian dauden azaletan Acinetobacter generoko beste espezie batzuekin batera.[3] Dena den, mikroorganismoaren agerpena eta azaleko-infekzioen arteko lotura urria da. Azal-infekzioak eragiten dituzten populazioen %3-a soilik dagokio A.baumannii-ri. Azterketa bera, etxebizitzarik gabeko pertsonen artean burutzerakoan infekzio-tasa %22-ra igotzen da; honek higiene-ohiturek mikroorganismoaren hazkuntzan eragina dutela erakusten du.
Infekzioa jasateko beste talde arriskutsu bat militarrena da. Hauek, Irak bezelako guneetara heltzean, basamortuko baldintza lehor eta aretsuak direla eta, patogenoarentzako infekzio-aukera bikainak izaten dira. Gaur egun, bakterio honen jatorria gune jakin batzuetan kokatzen den arren, asko zabaltzen ari da Britainia eta Ameriketako Estatu Batuetan batez ere, bertako armadan lan egiten duten gaixoak ospitaleetan tratatzen dituztelako. [5]
Acinetobacter generoko espezieak, zenbait elikagaietan eta bereziki barazkietan ager daitezke. Hortaz, ospitaleetako janaria ere mikroorganismoaren itu izan daiteke. Oro har, ospitaleetan kutsatuta agertzeko arrisku gehien duten materialak kortinak, gaixoa altxatzeko tresnak eta atearen heldulekua dira. Arreta berezia behar du, halaber, arnasketarekin eta zaurien zainketarekin erlazionatutako tresnen (laringoskopioak...) desinfekzioak.
Genoma aldatu
Mikroorganismoaren material genetikoaren azterketak informazio ugari ematen digu. Aipatu bezala, Acinetobacter generoko espezien guanina-zitosinaproportzioa %39-47 bitartekoa izaten da.
Genomaren osagaiei dagokionez, gene kodetzaile gehienak metabolismoari eta garraioari lotuta agertzen dira, eta gene kodetzailearen kantitate murritzena zelula zatiketara bideratutakoa da.
Genoma tresna baliagarria da Acinetobacter generoaren baitan espezie mailako identifikazioa burutu ahal izateko. Halaber, ikusi da A.baylyi espeziearen BD413 trpE27 andui mutatua gai dela edozein Acinetobacter-en DNA-rekin kontaktuan bere forma basatira itzultzeko. Hortaz, konjugazio honen azterketak generoko espezieak identifikatzeko balio du. Ildo beretik, genoma-azterketaren tekniken bidez espezie mailako sailkapen zehatzak lor daitezke; kasu askotan azterketa fenotipikoak baino askozaz ere zehatzagoak direnak. Anplifikaturiko 16S rRNA genearen errestrikzio analisia (ARDRA), RpoB genearen sekuentziazioa eta AFLP (amplified fragment lenght polymorphism) dira teknika erabilienetakoak. [3]
Metabolismoa aldatu
Derrigorrezko aerobioa da eta kimioorganotrofo heterotrofoa. Honez gain, prototrofoa da, hau da, ez du inolako substantzia organiko espezifikorik behar hazteko, beharrezko dituen hazkuntza-faktore guztiak bere kabuz sintetizatzeko gai da. Karbohidratoez baliatuz, hazteko gai da, metabolismo zentraleko hainbat bide burutzen dituelako. Hala nola, glukoneogenesia, pirubatoaren oxidazioa, zitratoaren zikloa, pentosa fosfato bidezidorra... edo bestelako bidezidor batzuen bidez.
Aipatzekoa da A. baumanni-k ez duela glikolisirik burutzen. Halaber, ez da pentosa fosfatoen bide oxidatiboa, edo glikano eta glukosaminoglikanoen sintesia egiteko gai. Gainera, mikroorganismo ez hartzitzailea da. Mikroorganismo bidezko lur kutsatuen bioerremediazioa. Karbohidrato lurrintsuen degradazioa burutu dezake. Hau burutzeko gai diren mikroorganismoek, molekula bakoitzarentzako monooxigenasa entzima espezifiko bat erabiltzeaz gain, bide periferiko deritzen prozesu biokimikoak burutzen dituzte. Hauen bitartez, xurgatzen dituzten substantzia aromatikoen eraztunak apurtzen dituzte degradatu ahal izateko. Azken bide honek aplikazioak ditu biorremediazioan; petroleoz kutsatutako guneak garbitzeko erabili izan da.[6]
Mikroorganismoa oxidasa negatiboa izanik, ez dauka c zitokromo oxidasarik. Ezaugarri hau, Moraxellacea familia beste espezietatik bereizteko erabiltzen da.
Aipagarria da, 22-40 °C bitarteko tenperaturetan bizi daitekeela, baina honen tenperatura optimoak 30-35 °C bitartean daude.
Epidemiologia aldatu
Acinetobacter ospitaleetan oso ugaria izateko arrazoi nagusi bat dago: ospitaleetan antibiotikoen erabilera maiz burutzen denez, hauekiko erresistenteak diren bakterioen “hautaketa” burutzen da. Horrenbestez, antibiotikoekiko erresistenteak diren bakterioek bizirauten dute, inguruko baliabideak eskuratzeko lehia murriztuta gelditzen da eta populazioaren handipena arazorik gabe burutu.
A.baumannii-k bakterio gram negatiboek sortutako infekzioen %2-10 eragiten ditu. 2002-2007 urteen artean Estatu Batuetan infekzio kasuek nabarmen egin zuten gora, gehienbat inmunogutxiegitasuna pairatzen zuten pertsonengan.
Transmisio bide nagusiena ospitaleko material abiotikoak dira. Gainera, transmisio eta infekzio kasuek nabarmen egiten dute gora zainketa intentsiboetako unitateetan. Espainian, infekzioen %90 ospitaleetan eskuratutakoak dira eta soilik %4 ospitalez kanpoko guneetan. Infekzioen gehiengoa arnas bideetakoak dira (%39), larruazalekoak (%24) gernu-aparatuan (%23) eta gutxi batzuk odol hodietakoak (%3).
Patogenizitate-mekanismoak aldatu
Azken urteetan ikerketa ugari burutu diren arren, oraindik ere, bada zer aztertu A.baumannii-ren birulentzia-mekanismoen inguruan. Ikusi da adibidez, OmpA, kanpo mintzeko proteinak, patogenizitate handia duela. Proteina hau ostalariaren epitelio eta mitokondrioetara atxikitzen da. Hala, mitokondrioetako disfuntzioa eragiten du (puztu egiten dira) eta jarraian c zitokromoaren gehiegizko jariapena hasten da, apoptosomak eratuz. Erreakzio-kate honek, azkenerako, zelulen apoptosia eragiten du.
OmpA mikroorganismoaren gainazal-proteina ugariena da, eta hortaz, biofilmen eraketan garrantzia berezia hartzen du. Ikusi da fosfolipasa D eta C proteinek ere A.baumannii-ren birulentzian eragiten dutela. Erresistentzia gehigarria dira mikroorganismoarentzat eta honen toxizitatea handiagotzen dute.
Erresistentzia-mekanismoak aldatu
A.baumannii-k genoma aldatzeko gaitasun ikaragarria du eta honenbestez erresistentzia-mekanismoak eskuratzekoa ere bai. Bakterioen aurkako tratamendu ugari dauden lekuetan hazteko gai da, ospitaleetako zainketa intentsiboko guneetan adibidez. Ikusi da erresistentzia-gene asko sekuentzia motzetan pilatzen direla “ erresistentzia irlak” deritzen guneetan (Aba R izenez ezagutzen direnak). Gune hauetako transferentzia horizontala ematen da maiz. Tetraziklina, kloranfenikola, aminoglikosidoa eta aminozitolekiko erresistenteak diren irlak identifikatu dira. Hainbat erresistentzia mekanismo ezagutzen dira.
A.baumannii-k, biofilmak eratzeko duen gaitasunari esker, muturreko baldintza eta inguruneetan hazteko gai da. Biofilmak era ditzake baldintza abiotikoetan, ospitaleetako material esterilizatuan besteak beste; bai eta gure organismoko epitelio ehunetan.
Biofilmak mikroorganismoen zelulen taldekapenak dira, eta hainbat exopolisakaridoz osatutako matrize batez inguraturik egoten dira. Matrize honek, babesa emateaz gain, sustratura atxikitzeko gaitasuna ere ematen die.
Antibiotikoak inaktibatzen dituzten entzima ezagunenak beta-laktamasak dira, penizilina eta zefalosporinak bezalako antibiotiko beta-laktamikoak hidrolizatzeko gai direnak. Carbapanem-ak, beta-laktamasen jarduera inhibitzeko sintetizatutako antibiotikoak dira berez, baina, ikusi da A.baumannii, OXA-51 taldeko entzimen bidez hauek suntsitzeko gai dela.
Antibiotiko asko eta asko mintzeko porinen bitartez sartzen dira zeluletara. A.baumannii-k oso porina txikiak ditu ordea, eta honek tratamenduaren insertzioa are zailagoa bihurtzen du. Gainera, mintz zelularrean zenbait kanporatze-ponpa ditu, antibiotikoak ingurune extrazelularrera bideratzeko gaitasuna dutenak.
Honez gain, zenbait andui mutagenikok (gyrA eta parC geneak) mintzaren atxikimendu-guneetan aldaketa konformazionalak eragiten dituzte, antibiotikoekin lotzea oraindik ere gehiago zailduz. Azken ikerketen arabera, antimikrobiralen gehiegizko erabilerak ere anduien arteko konjugazioak eta erresistentzia faboratzen ditu. [7]
Gaixotasunak aldatu
A.baumannii-k organo guztiak infekta ditzake, baina infekzio gehienak fluxu altuko guneetan kokatzen dira, hala nola, biriketan, gernu maskurian edo sabelaldeko likido peritonealean. Ohiko gaixotasunak pneumonia, odol-fluxuko infekzioak eta meningitisa dira.
Ondorio patologiko garrantzitsuenak arnas-hodietako infekzioen ondoriozkoak dira. VAP pneumonia (ventilator associated pneumonia) biriketako infekzioa da, ospitaletan arnasteko makinak behar dituzten pazienteetan ohikoa. Izan ere, hodi endotrakeala primerako habitata da A. baumannii-rentzako, plastikora azkar itsas daitekeelako eta hodian biofilmak sortu. Pneumonia honen agerraldia erlazionatuta egon daiteke langileak eramaile oportunistak izatearekin, higiene-baldintzak egokiak ez direnean batez ere.
Ospitaletik kanpoko pneumonia: Ospitaletik kanpo eta A. baumaniik sortutako pneumoniaren kasuak Australia eta Asian eman dira soilik. Infekzioen jatorria eztarri garraioa dela uste da eta ohikoagoa da alkohol eta tabakoaren kontsumoa handia izanik. Bat-bateko krisi batekin hasten da eta odol-fluxura hedatuz doa. Hilkortasun-tasa %40-60 artean dago.
Odol-fluxuko infekzioak: Odol-fluxuko infekzio nosokomialen %1,3ak Acinetobacter-ek sortzen ditu, ohikoago delarik ZIU-n (Zaintza Intentsiboko Unitatea) dauden gaixoetan. Hilkortasun-tasa %16.3koa da ZIUtik kanpo eta %34 eta % 43.4 artekoa ZIUko gaixoengan. Honek hirugarren hilkortasun-tasarik handienarekin kokatzen du Acinetobacter ZIU barruan, soilik Pseudomonas aeruginosa eta Candida espezieen ondoren.
Meningitisa: Meningitis nosokomiala gero eta arruntagoa bilakatzen ari da operazioen ostean eta bere hilkortasun-tasa oso handia da, %70-era helduz.[7]
Tratamenduak aldatu
Antibiotikoekiko garatutako erresistentzia dela eta, ez da batere erraza tratamendu eraginkorrak aurkitzea.[5]
Gehien erabiltzen zen antibiotikoa Carbapanem-a zen, beta-laktamasei oso erresistentea delako, baina azken urteotan antibiotiko honi erresistenteak diren zenbait andui agertu dira, tratamendu-aukerak are gehiago murriztuz.
Beste aukera bat tigeziklina antibiotikoa da, zain barneko injekzioen bidez ematen dena. Baina ez da lagungarria kasu guztietan eta 2 μg/ml edo gehiagoko dosiak emanez gero, hilkortasun-tasa handitu egiten da. Hau dela eta, tigeziklinaren alternatiba gisa minozizlinaren erabilera testatzen ari da. Orokorrean nahiko metodo arrakastatsua da baina hemen ere andui erresistenteak agertu dira; A.baumanii anduien %20a ez da minozizlinarekiko sentibera.
Tetraziklinen ordez, sulbactam antibiotikoa ere frogatzen ari dira. Sulbactam beta-laktamasa entzimak inhibitzeko erabiltzen da patogeno askoren kasuan, entzima beta laktamikoetara lotzen da eta beraien jarduera eteten du.Desabantaila nagusia konposatua derrigorrean anpizilinarekin konbinatuta eskuratu beharra dagoela da.
Antibiotiko gehienen limitazioak ikusita, polimixina da azken urteotan erabilera handiena izan duen konposatua. Eraginkorra da, baina zoritxarrez, dosi efektiboak toxikoak dira. Gainera, erresistentzia-kasu berri batzuk agertu dira.
Egoera ikusita, enpresa farmazeutiko asko antibiotiko berrien bila dabiltza, jada ezagunak direnen konbinazioak eginez. Bakteriofagoen bidezko tratamenduak ere frogatzen ari dira, A. baumanii – ren fago espezifikoekin (AB1 eta AB2). Dena den, oraindik ere erabilpen klinikotik urrun dauden tratamenduak dira.[8][9]
Erreferentziak aldatu
- ↑ Yeom, Jinki; Shin, Ji-Hyun; Yang, Ji-Young; Kim, Jungmin; Hwang, Geum-Sook. (2013-03-06). «1H NMR-Based Metabolite Profiling of Planktonic and Biofilm Cells in Acinetobacter baumannii 1656-2» PLoS ONE 8 (3): e57730. doi:. ISSN 1932-6203. (Noiz kontsultatua: 2019-05-17).
- ↑ Bicknell, Joan. (1989-05). «Mental Handicap: A Community Service. By Nick Bouras, Katie Drummond, David Brooks and Matt Laws. NUPRD, Lewisham Hospital, London SE13. 1988. Pp. 47. £5.00.» Psychiatric Bulletin 13 (05): 267. doi:. ISSN 0955-6036. (Noiz kontsultatua: 2019-05-17).
- ↑ a b c Howard, Aoife; O’Donoghue, Michael; Feeney, Audrey; Sleator, Roy D.. (2012-05). «Acinetobacter baumannii» Virulence 3 (3): 243–250. doi:. ISSN 2150-5594. (Noiz kontsultatua: 2019-05-17).
- ↑ Rosen, B; O'Leary, E; Shan, Y; Pat, W; Peter, B. (2018-02-14). «Abstract P4-06-09: Addition of a remote genetic counselor to the breast specialist's team improves clinical decision-making» Cancer Research 78 (4 Supplement): P4–06-09-P4-06-09. doi:. ISSN 0008-5472. (Noiz kontsultatua: 2019-05-17).
- ↑ a b Singh, Harmanjit; Natt, Navreet; Garewal, Nipunjot; T, Pugazhenthan. (2013). «Bedaquiline: a new weapon against MDR and XDR-TB» International Journal of Basic & Clinical Pharmacology 2 (2): 96. doi:. ISSN 2319-2003. (Noiz kontsultatua: 2019-05-17).
- ↑ «METABOLIC PATHWAYS» Metabolic Regulation (Elsevier): xix–xx. 1971 ISBN 9780122992551. (Noiz kontsultatua: 2019-05-17).
- ↑ a b Howard, Aoife; O’Donoghue, Michael; Feeney, Audrey; Sleator, Roy D.. (2012-05). «Acinetobacter baumannii» Virulence 3 (3): 243–250. doi:. ISSN 2150-5594. (Noiz kontsultatua: 2019-05-17).
- ↑ Maragakis, Lisa L.; Perl, Trish M.. (2008-04-15). «Antimicrobial Resistance:Acinetobacter baumannii:Epidemiology, Antimicrobial Resistance, and Treatment Options» Clinical Infectious Diseases 46 (8): 1254–1263. doi:. ISSN 1058-4838. (Noiz kontsultatua: 2019-05-17).
- ↑ Wong, Darren; Nielsen, Travis B.; Bonomo, Robert A.; Pantapalangkoor, Paul; Luna, Brian; Spellberg, Brad. (2016-12-14). «Clinical and Pathophysiological Overview of Acinetobacter Infections: a Century of Challenges» Clinical Microbiology Reviews 30 (1) doi:. ISSN 0893-8512. (Noiz kontsultatua: 2019-05-17).