Sulfato
Sulfatoa azido sulfurikoaren gatza edo esterra da. Sufre atomo bat dute lau oxigeno atomoz osatutako tetraedro baten erdian. Sulfato-gatzek SO42- anioia dute.
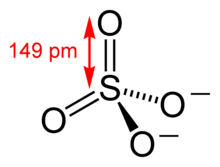
Bi mota nagusi bereizten dira sulfatoetan: sulfato ez-organikoak, azido sulfurikoaren eta metal baten alkaliaren arteko loturaren ondoriozkoak, neutroak, azidoak edo bisulfatoak, basikoak, bikoitzak eta pirosulfatoak izan daitezkeenak (igeltsua, baritina, sodio sulfatoa...); eta sulfato organikoak, base organiko baten eta alkoholetatik ateratako esterren arteko loturaren ondoriozkoak.
Erreferentziak aldatu
- Artikulu honen edukiaren zati bat Lur hiztegi entziklopedikotik edo Lur entziklopedia tematikotik txertatu zen 2011/12/27 egunean. Egile-eskubideen jabeak, Eusko Jaurlaritzak, hiztegi horiek CC-BY 3.0 lizentziarekin argitaratu ditu, Open Data Euskadi webgunean.