Lotura kobalente
Lotura kobalentea bi atomoren artean elektroi-pareen banaketa oinarritzat hartzen duen lotura kimikoa da. Bi atomoen artean, lotura kobalentea hau osatzen duten atomoek zortzikotearen araua betetzeko ematen da. Hau honela izan dadin, loturan atomo bakoitzak bere balentzia orbitalean[1] dauden elektroiak partekatzen dituzte. Lotura kobalentea eratzeko, bi atomoen arteko elektronegatibitate-diferentzia[2] 1,7 baino txikiagoa izan behar da. Lotura hau elementu berdineko ez-metalen, elementu ezberdineko ez-metalen eta hidrogeno eta ez-metalaren artean ematen da.[3][4][5] Bi atomoren artean elektroi bat, bi edo hiru parteka daitezke; ondorioz, lotura bakuna, bikoitza edo hirukoitza osatuko da. Lewis egituran bi atomoen artean marra bat (lotura bakunaren kasuan) marrazten da haien arteko lotura adierazteko.
Lotura kobalenteen artean elkarrekintza mota asko daude σ lotura, π lotura, metal-metal lotura, elkarrekintza agostikoa, lotura flexionatuak eta hiru zentro eta bi elektroi loturak[6][7]. Terminoa 1939an sortu zen[8], eta ko- aurrizkia eta balentzia hitzak elkartzen ditu.
Historia aldatu
"Kobalente" hitza lehenengo aldiz 1919. urtean hasi zen erabiltzen Irving Langmuirrek idatzitako artikuluan :Journal of the American Chemical Society[9][10]. Artikulu honentan Langmuirrek hau idatzi zuen: «bi atomok partekatzen dituzten elektroi pare kopuruari kobalente deituko diogu».
Lotura kobalentearen ideia Gilbert N. Lewisek[11][11] sortu zuen, zeinek 1916. urtean atomoen arteko elektroi pareen trukaketa azaldu zuen. Lewisek egitura-notazioa sartu zuen, non balentzia elektroiak atomoaren inguruan dauden puntuen bidez adierazten diren. Baina, loturak adierazteko beste modu bat dago: marra bat marraztea.
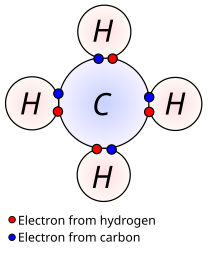
Lewisek proposatu zuen atomo batek lotura kobalente nahikoak osatzen dituela kanpoko geruza elektronikoa osatzeko. Goian azaltzen den metanoaren diagraman, karbono-atomoak lau balentzia-elektroi ditu; ondorioz, lau elektroiez inguratuta dago (zortzikoteko araua). Hidrogeno bakoitzak bat balentzia dauka eta bi elektroiez inguratuta dago (bere elektroi propioa eta karbonoaren elektroia). Elektroi kopurua betetako geruzei dagozkie; karbono-atomo baten kanpoko geruza n=2 geruza da eta zortzi elektroi sar daitezke; aldiz, hidorgeno atomo baten kanpoko geruza (geruza bakarra) n=1 geruza da eta bi elektroi sar daitezke.
Molekula sinpleen propietateak eta estrukturak ulertzeko beharrezkoa da mekanika kuantikoa. 1927[12]. urtean Walter Heitler eta Fritz London-ek lotura kimikoa azaldu zuten mekanika kuantikoan oinarrituz[12], zehazki, hidrogeno molekularrarena. Lanean azaltzen dute lotura kobalentea osatzen dela parte hartzen duten atomoen orbital atomikoak berdintsuak direnean.
Lotura kobalentearen teoriak, atomo kubikoan oinarrituta dagoenak, hainbat arazori aurre egin behar izan zion, hain zuzen ere lotura ionikoaren teoria konpetentzia izan zen. Arazoak eduki arren, lotura kobalentea 1920.urtean onartu zen. M.Niaz eta M.A.Rodríguez-ek Historia y filosofía de las ciencias testuan aipatu zuten beharrezkoa dela unibertsitateko testu zientifikoetan azaltzea estruktura kubikoak ezin duela lotura hirukoitza azaldu. Horregatik, atomo tetraedrikoa kubikoa ordezkatu zuen.
Substantzia kobalente motak aldatu
Bi sustantzia kobalente mota daude: kobalente molekularrak (bentzenoa) eta sare edo kristal kobalenteak (kuartzo kristalak).
Substantzia kobalente molekularrak: lotura kobalenteek honako propietatedun molekulak osatzen dituzte:[13][14]
- Fusio- eta irakite-tenperatura baxuak.
- Presio eta tenperatura arruntetan solido, likido edo gasak izan daitezke.
- Solido eran bigunak dira.
- Isolatzaileak dira korrote elektriko eta beroarekiko.
- Disolbagarritasunaren ikuspuntutik molekula polarrak disolbatzaile polarretan eta apolarrak disolbatzaile apolarretan disolbatzen dira.
- Adibidez: bentzenoa, oxigenoa, nitrogenoa, CO2...
Sare edo kristal kobalentedun substantzia molekularrak: substantzia kobalenteek atomo kopuru ezberdindun sare kristalinoak osatzen dituzte zeinak konposatu ionikoen antzekoak diren. [12]Honako propietateak erakusten dituzte:
- Fusio- eta irakite-tenperatura altuak.
- Egoera normalean solidoak dira.
- Oso gogorrak dira.
- Isolatzaileak dira (grafitoa izan ezik):
- Ez dira disolbagarriak.
- Adibidez: kuartzoa, diamantea...
Lotura kobalentearen definizioa aldatu
Hidrogeno-atomoen kasuan oinarrituz, elkartzen doazen heinean elektroi bakoitza beste atomoaren nukleora erakartzen duten indarrak nabaritzen hasten dira, erakarpen-indar hauek konpentsatzen diren arte elektroiek haien artean duten aldarapenaren ondorioz. Puntu horretan du molekulak bere konfiguraziorik egonkorrena.
Elektroien orbitalak gainezarri egiten dira eta honela ezin da desberdiindu zein atomori dagokion elektroi bakoitza.
S. Seese eta G William Daub kimikarien arabera, hidrogeno molekulan, beste substantzia kobalente guztietan bezala, lau ezaugarri hartu behar dira kontuan:
- Atomoak banaka dituzten propietateak oso desberdinak dira molekularekin konparatuz, horregatik hidrogenoaren formula molekularra idaztean H2 bezala idatzi behar da molekula diatomiko bat delako.
- Bi nukleo positiboek bi elektroiak erakartzen dituzte molekula egonkorrago bat sortzeko, hau da, lotura bat sortzen da honela molekula egonkorragoa egiteko atomo bananduak baino. Nukleoek elektroiei eragiten duten erakarpenari esker haien arteko aldarapena erregulatzen da eta horregatik elektroiak aurkitzeko probabilitate handieneko gunea bi nukleoen artean kokatzen da.
- Nukleoen arteko distantzia hain handia da 1s orbitalek duten gainjartze maximoa. Hidrogeno-molekularen kasuan bi nukleoen arteko distantzia 0,74 Å-ekoa da gutxi gorabehera. Beste era batera esanda, kobalenteki elkartzen diren bi atomoen arteko distantzia lotura-luzera deitzen da.
- Gas-egoeran dagoen 1,0 g hidrogenoren lotura kobalenteak hautsi eta hidrogeno atomoak eratzeko 52,0 kcal behar dira.[10]
Bestalde, atomoak desberdinak direnean partekatutako elektroiak ez dira berdin erakarriak izango eta hauek atomo elektronegatiboenera hurbiduko dira gehien. Fenomeno honek polaritate (elektronegatibitate handieneko atomoek polaritate negatiboagoa hartzen dute partekatutako elektroiak bere nukleorantz erakarriz) izena hartzen du eta molekula baten barneko kargen desplazamenduan oinarritzen da.
Esan daiteke atomo elektronegatiboenek ez dutela gustuko bere elektroiak elkarbanatzea beste atomoekin, eta muturreko kasuetan elektroia hartuko duela besterik gabe, hauetan lotura ionikoa eratuz. Horren ondorioz esaten da lotura kobalente polarrek izaera partzialki ionikoa dutela.
Elektronegatibitate-diferentziarik ez dagoenean (bi atomo berdin), sortutako lotura kobalente purua izango da; elektronegatibitae diferentzia 1,9 denean izaera ionikoa % 35ekoa izango da eta diferentzia 3koa denean, berriz, % 49,5ekoa. Honela esan daiteke elektronegatibitate-diferentzia 1,7tik aurrera doanean molekulak izaera ionikoa handitzen doala. Oxigeno edo fluorra 1 eta 2 taldeko elementuekin konbinatzean elektronegatibitate-diferentzia maximoa da beraz, bere izaera ionikoa ere.
Elektronegatibitate-diferentzia 0 eta 1,7 tartean dagoenean izaera kobalentea izango da gailenduko dena, adibidez, C-H-ren kasua. Baina Raymond Chang kimikariaren arabera, diferentzia hau 2,0 baino handiagoa izan behar da lotura ioniko kontsideratzeko.
Elektronegatibitate-diferentziaren arabera lotura kobalentea kobalente polar eta koalente apolar edo puruak daude. Elektronegatibitate-diferentzia 0,4 eta 1,7 artean badago lotura kobalente polarra da eta 0,4 baino txikiagoa bada, berriz, kobalente apolarra.
Polaritatea molekula koobalenteetan aldatu
Lotura kobalentean parte hartzen duten atomoen polaritatearen arabera lotura kobalente polar eta apolarrak desberdintzen dira.
- Lotura kobalente polarrak: Elementu desberdinen arteko atomoen arteko loturen eraketan oinarritzen da eta elektronegatibitate-diferentzia 0,5 baino handiagoa izan behar da. Lotura honetan elektroiak atomo elektronegatiboenaren nukleoak erakartzen ditu honela hodei elektronikoa deformatu egiten da karga negatibo gehiago duen gune bat karga positibo gehiagoko beste gune batetik (dipoloak) urrunduz.
- Lotura kobalente apolarrak: Atomo berdinen artean gertatzen da eta elektronegatibitate desberdintasuna zero edo oso txikia (0,4 baino txikoagoa) izan behar da. Lotura honetan nukleoak intentsitate berarekin erakartzen dituzte elekroiak eta beraz hodei elektronikoa uniformeki mantentezen da.
Lotura kobalente motak aldatu
- Lotura bakuna: elektroi pare bakarra partekatzen da bi molekulen artean, elektroi bakoitza loturan parte hartzen duten atomoen azken energia mailan dagoelarik. Lotura marra batez adierazten da. Adibidez: H-H
- Lotura bikoitza: bi elektroi pare partekatzen dira, hau da, loturan parte hartzen duen molekula bakoitzak bere azken geruzan dituen bi elektroi elkarbanatuz. Bi marrekin adierazten da. Adibidez: O=O
- Lotura hirukoitza: hiru elektroi pareen hartean ematen da, atomo bakoitzak bere azken geruzan dituen hiru elektroi partekatuz. Hiru marrekin adierazten da. Adibidez: N≡N
- Koordinaziozko lotura kobalentea: bi atomoren artean partekatutako elektroi pare bat da baina kasu honetan bi elektroiak atomo berdinak emanak dira. Gezi baten bidez adierazten da (→). Adibidez amonio ioia (NH4+) protoi batek eta amoniakoak osatzen dute lotura hau. Koordinazio lotura kobalentedun konposatuak koordinazio konposatu bezala ezagutzen dira.[12]
Erresonantzia aldatu
Zenbait kasutan Lewis estruktura batek ez digu molekula baten konfigurazio elektronikoa zehazki azaltzen; horregatik, estrukturen superposizioa behar da kasu horiek azaltzeko. Molekula hauetako bi atomo berdinek lotura ezberdinak izan ditzakete bi estruktura ezberdinetan; adibidez, estruktura batean lotura bakuna osatu dezakete, baina bestean, bikoitza. Hau horrela, lotura-ordena ez litzateke zenbaki osoa izango.
Erresonantzia-egituren isla nitrato ioia da, hiru egitura baliokide osatzen baditu. Nitrogeno-oxigeno loturak honakoak dira: lotura bikoitz bat eta bi lotura bakun. Lotura bikoitz hori aldatu egiten da egitura erresonanteaz aldatzen dugunean, hau da, egitura erresonante ezberdinetan lotura bikoitz hori nitrogenoak oxigeno ezberdin batekin eratuko du. Ondorioz, N-O lotura-ordena honakoa izango da:
Aromatizitatea aldatu
Kimika organikoan, molekula batek Huckelen legea betetzen duen eraztun lau bat badu, egonkortasun-igoera jasaten du. Egoera aromatiko ezagunena bentzenoa da, non molekula honek hiru lotura bikoitz deslokalizatuak dituen. Lotura bikoitz hauek direla eta, bentzenoak bi egitura erresonante erakusten ditu, ondorioz, egonkorragoa da 1,3,5-ziklohexatrieno hipotetikoa baino.
Heteroziklo aromatikoak edota bentzeko ordezkatuen kasuan, eraztuneko elektronegatibitate ezberdintasunek zehazten dute eraztun aromatikoko loturen jokaera kimikoa.
Hiperbalentzia aldatu
Zenbait molekulek, XeF2 eta SF6 adibidez, uste dena baino oxidazio-zenbaki handiagoa dute, hau da, ez dute zortzikotearen legea betetzen. Honako fenomeno hau 3-zentru 4-elektroi lotura bidez azaldu daiteke.
Elektroi gabezia aldatu
Kasu honetan aurkako fenomenoa dugu, 3-zentru 2-elektroi lotura osatzen da. Elektroi-gabeziko lotura hau diboranoan ikus dezakegu. Molekula honetan bi boroak protoi baten bidez lotzen dira. Hidrogeno hauek bi boroekin osatzen dute lotura momentu berean.
Erreferentziak aldatu
- ↑ (Gaztelaniaz) Segreda, Julio Francisco Mata. (2004). El Enlace Covalente. Editorial Universidad de Costa Rica ISBN 9789977679167. (Noiz kontsultatua: 2018-12-13).
- ↑ (Gaztelaniaz) Quimica 2. Ediciones Umbral ISBN 9789685607209. (Noiz kontsultatua: 2018-12-13).
- ↑ (Gaztelaniaz) Picazo, Susana María López. (2009). Química. Pruebas de acceso a la universidad para mayores de 25 años. Cultivalibros ISBN 9788499231099. (Noiz kontsultatua: 2018-12-13).
- ↑ (Gaztelaniaz) Química II Segundo Semestre Tacaná. IGER ISBN 9789929804623. (Noiz kontsultatua: 2018-12-13).
- ↑ Alba., Gutiérrez R., Eufrosina. (2004). La química en tus manos. Escuela Nacional Preparatoria, Dirección General ISBN 9703212239. PMC 61771499. (Noiz kontsultatua: 2018-12-13).
- ↑ 1929-1997., March, Jerry,. (1992). Advanced organic chemistry : reactions, mechanisms, and structure. (4th ed. argitaraldia) Wiley ISBN 0471601802. PMC 25204734..
- ↑ 1949-, Miessler, Gary L.,. (2004). Inorganic chemistry. (3rd ed. argitaraldia) Pearson Education ISBN 0130354716. PMC 52165864..
- ↑ (Ingelesez) Merriam-Webster. 2018-05-15 (Noiz kontsultatua: 2018-05-31).
- ↑ Langmuir, Irving. (1919-06-01). «THE ARRANGEMENT OF ELECTRONS IN ATOMS AND MOLECULES.» Journal of the American Chemical Society 41 (6): 868–934. doi:. ISSN 0002-7863. (Noiz kontsultatua: 2018-12-13).
- ↑ a b S., Seese, William. (1989). Química. (1a ed. en español. argitaraldia) Prentice-Hall Hispanoamericana ISBN 9688801674. PMC 22484066. (Noiz kontsultatua: 2018-12-13).
- ↑ a b Lewis, Gilbert N.. (1916-04-01). «THE ATOM AND THE MOLECULE.» Journal of the American Chemical Society 38 (4): 762–785. doi:. ISSN 0002-7863. (Noiz kontsultatua: 2018-12-13).
- ↑ a b c d Quantum chemistry : classic scientific papers. World Scientific 2000 ISBN 9789812795762. PMC 827947331. (Noiz kontsultatua: 2018-12-13).
- ↑ «Compuestos covalentes moleculares» www.deciencias.net (Noiz kontsultatua: 2018-12-13).
- ↑ (Gaztelaniaz) Antón, Juan Luis; Andrés, Dulce María. (2015-06). Física y Química 3º ESO (LOMCE). Editex ISBN 9788490785270. (Noiz kontsultatua: 2018-12-13).
Ikus, gainera aldatu
Kanpo estekak aldatu
| Wikimedia Commonsen badira fitxategi gehiago, gai hau dutenak: Lotura kobalente |