Fosfato
Fosfatoa azido fosforikotik eratorritako gatza edo esterra da, bere egituran PO4 taldea (fosforo atomo bat lau oxigeno atomo forma tetraedrikoan inguraturik) eta metal alkalino edo lurralkalinoak ditu. Molekulan dituzten metal-kopuruen eta hidrogeno-edukiaren arabera, konposatu monobasikoak, dibasikoak edo tribasikoak eratzen dituzte. Fosfato naturalen artean ezagunena eta garrantzitsuena fosforitan ugari aurkitzen den ortofosfato kaltzikoa da: Ca3(PO4)2. Fosfato ez-organikoak asko erabiltzen dira nekazaritzan ongarri edo herbizida moduan.
| Fosfato | |
|---|---|
 | |
| Mota | phosphorus compound (en) |
| Masa molekularra | 94.9714 g mol−1 |
| Identifikatzaileak | |
| Gmelin | 26020 |
| MeSH | D010710 |
| NDF-RT | N0000022459 |
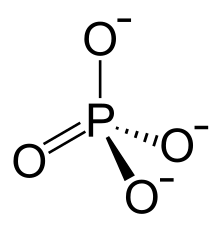
Fosfato organikoei organofosfato deritze. Azido fosforikoaren esterrak dira, eta gainerako fosfatoak baino molekula konplexuagoak dira. Garrantzi handia dute biokimikan.
Ezaugarri kimikoak aldatu
Fosfato ohikoenak ortofosfatoak dira[1]. Fosfato edo ortofosfato ioia [PO4]3−, 94.97 g/mol masa molarraz, azido fosforikoaren deribatua da, protoien H+ galeratik eratorria. Protoi bakar bat galtzean dihidrogeno fosfato ioia [H2PO4]− osatzen da, eta bi protoien galeraz hidrogeno fosfato ioia [HPO4]2−. Izen hauek anioi horien gatzak izendatzeko ere erabiltzen dira. Honela fosfato ioia hidrogeno fosfatoaren HPO42−-ren base konjokatua da, hau aldi berean H2PO4− ioiaren base konjokatua da, eta azken hau berriz azido ortofosforikoarena H3PO4.
Fosfato gehienak ez dira uretan disolbagarriak tenperatura eta presio estandarrean. Sodio, potasio, rubidio, cesio eta amonio fosfatoak uretan disolbagarriak dira. Baina beste hainbat fosfato disolbaezinak dira, edo oso gutxi disolbatzen dira. Oro har, hidrogeno eta dihidrogeno fosfatoak dagozkien fosfatoak baino disolbagarriagoak dira.
Orekak aldatu
Ur-disoluzioan, azido ortofosforikoa eta honen hiru anioi deribatuak elkarrekin aurkitzen dira ondorengo disoziazio oreken arabera[2]:
| Oreka | Disoziazio konstantea Ka[3] | pKa |
|---|---|---|
| H3PO4 ⇌ H2PO−4 + H+ | Ka1 = [ H+] [ H2PO−4 ] / [ H3PO4 ] ≈ 7.5 × 10−3 | pKa1 = 2.14 |
| H2PO−4 ⇌ HPO2−4 + H+ | Ka2 = [ H+] [ HPO2−4 ] / [ H2PO−4 ] ≈ 6.2 × 10−8 | pKa2 = 7.20 |
| HPO2−4 ⇌ PO3−4 + H+ | Ka3 = [ H+] [ PO3−4 ] / [ HPO2−4 ] ≈ 2.14 × 10−13 | pKa3 = 12.37 |
pKa balioak, 25 °C-tan eta indar ionikoa 0 denean.
pH-a 1 edo baxuago denean, azido fosforikoa ia ez dago disoziatuta. pH 4,7 inguruan (lehen bi pKa balioen artean) dihidrogeno fosfato ioia, [H2PO4]-, ia espezie bakarra da. pH 9,8 inguruan (bigarren eta hirugarren pKa balioen artean) hidrogeno fosfato ioia, [HPO4]2−, nagusitzen da. Azkenik, pH 13 edo altuagoa denean, azido fosforikoa ia erabat disoziatuta dago fosfato ioi moduan [PO4]3−.
Fosfatek ioi polimeriko ugari sor ditzake; besteak beste, pirofosfatoa, (P2O7)4−, eta trifosfatoa, (P3O10)5−.
Non aurkitzen dira? aldatu
Fosfatoak naturan modu askotan aurkitu daitezke. Hainbat dira fosfatodun mineralak, horien artean ohikoenak apatita taldekoak dira[1][4]. Apatita edo apatitoaren konposizio kimikoa Ca5(PO4)3(OH, F, Cl) adierazten da. Hiru anioi horien, OH−, F− edo Cl−, artean nagusitzen den elementuaren arabera hidroxiapatita, fluorapatita eta klorapatita bereizten dira hurrenez hurren. Bestalde, fosfatoa gure hortzetako eta hezurretako osagai ezinbestekoa da[1].
Fosfatoen biokimika aldatu
Sistema biologikoetan, fosforoa fosfato anioi libre gisa aurki daiteke disoluzioan (fosfato ez-organikoa) edo molekula organikoez lotuta ager daitezke organofosfato gisa.
Fosfato ez-organikoa Pi moduan adierazten da, eta pH fisiologikoan (pH = 7), nagusiki, HPO42− eta H2PO4− ioien nahasketa aurkitzen da.
Fosfato ez-organikoa pirofosfato (P2O74−) anioi moduan ere ager daiteke, PPi laburduraz adierazten dena. Honen hidrolisiaz bidez ortofosfatoak lor daiteke: P2O24- + H2O ⇔ 2 HPO42−
Organofosfatoei dagokionez, hauek ester moduan aurkitu ohi dira nukleotido gisa (adb:. AMP, ADP eta ATP) eta DNA eta RNAn. ATP edo ADP-en hidrolisiaz fosfato taldea askatzen da, lotura apurtzean energia handia askatzen delarik. Hain zuzen, fosforilazio eta desfosforilazio erreakzio horiek, energia metatzeko nahiz energia iturri gisa erabiltzen dira hainbat prozesu metabolikoetan. Bestalde, aurrez esan bezala, fosfatoak azido nukleikoen osagai dira. Eta mintzak osatzen dituzten zenbait lipidoren parte ere badira, fosfoglizeridoak kasu, non fosfato taldearen ezaugarriei esker buru hidrofilikoa osatzen duen.
Fosfatoen erabilera eta aplikazioak aldatu
Fosfatoen aniztasunaz batera, hainbat dira horien erabilera eta aplikazioak. Zenbait fosfato medikuntzan baliatzen dira, adibidez, gernu-bideetako zenbait infekzioen aurrean edo gernu-aparatuan kaltzio-harriak garatzea ekiditearren, fosfato batzuk erabiltzen dira[5]. Bestalde, eguneroko dietan fosforo nahikoa lortu ezin duten pazienteentzat, fosfatoak osagarri dietetiko gisa erabil daitezke[5]. Alabaina, gehiegizko fosforo mailak kaltegarriak izan daitezke osasunerako[6]. Bestetik, fosfatoak nekazaritzan ere baliatzen dira, ongarri moduan erabiltzen dira landareen hazkuntza indartzeko.
Bestelako erabilerak[7]:
- Gantz saponifikazio agentea gisa
- Pintura desugertzailea moduan, eta pintatu aurreko korrosio-aurkako tratamentuetan
- Industria mailan, metalak garbitzeko erabiltzen da
- Emultsionatzaile gisa gaztak egiteko
- Legamia artifizial gisa, nahiz azidotzaile gisa ogi orea prestatzeko
- Fluordun hortzetako pastetan urratzaile gisa
- Garbigarrietan
Eragin ekologikoa aldatu
Zenbait ingurunetara edo ekosistematara fosfato kontzentrazio altuak gehitzeak ondorio ekologiko handiak eragin ditzake. Izan ere, fosfatoa elikagai mugatzailea dela esan ohi da, alegia, honen kontzentrazioak organismoen hazkunde-tasa baldintzatzen dute. Gehiegizko fosfato mailek hainbat organismoren hazkuntza neurrigabekoa eragin dezakete ekosistemaren oreka apurtuz[8]. Honela, hiriko hondakin-uretan, nekazaritzan erabilitako ongarriez etab. isurtzen diren fosfatoak (nitrogeno eta fosforo nutriente inorganikoak oro har) ur-sistemetara iristean bertako alga fitoplanktonekoen elikagai bihurtzen dira. Ondorioz algak neurriz kanpo hazten hasten dira, eta honek aldi berean inguruneko oxigenoa agorrarazten du, gainerako espezieren kaltetan[8]. Fenomeno honi eutrofizazioa deritzo.
Fosfato depositu naturalek metal astun kopuru handiak izan ditzakete. Fosfatodun arrokekin diharduten meatze-jardueretan bada, kadmio, berun, nikel, kobre, kromo eta uranio maila altuak dituzten hondakinak sor daitezke. Hondakin horiek arretaz kudeatzen ez badira, metal astunak lurpeko uretara edo inguruko estuarioetara isuri daitezke, bertako landare eta itsas bizidunek horiek hartzean kate trofikoan sartuko liratekeelarik[9].
Erreferentziak aldatu
- Artikulu honen edukiaren zati bat Lur hiztegi entziklopedikotik edo Lur entziklopedia tematikotik txertatu zen 2011/12/27 egunean. Egile-eskubideen jabeak, Eusko Jaurlaritzak, hiztegi horiek CC-BY 3.0 lizentziarekin argitaratu ditu, Open Data Euskadi webgunean.
- ↑ a b c «Fosfato» www.quimica.es (Noiz kontsultatua: 2021-03-18).
- ↑ Campbell, Neil A.. (2005). Biology. (7th ed. argitaraldia) Pearson, Benjamin Cummings ISBN 0-8053-7171-0. PMC 57368924. (Noiz kontsultatua: 2021-03-18).
- ↑ Powell, Kipton J.; Brown, Paul L.; Byrne, Robert H.; Gajda, Tamás; Hefter, Glenn; Sjöberg, Staffan; Wanner, Hans. (2005-01-01). «Chemical speciation of environmentally significant heavy metals with inorganic ligands. Part 1: The Hg2+– Cl–, OH–, CO32–, SO42–, and PO43– aqueous systems (IUPAC Technical Report)» Pure and Applied Chemistry 77 (4): 739–800. doi:. ISSN 1365-3075. (Noiz kontsultatua: 2021-03-18).
- ↑ «Fosfatos» www.ehu.eus (Noiz kontsultatua: 2021-03-18).
- ↑ a b «Phosphate Supplement (Oral Route, Parenteral Route) Description and Brand Names - Mayo Clinic» www.mayoclinic.org (Noiz kontsultatua: 2021-03-18).
- ↑ «Actualizaciones en Nefrología 2009» Nefrología (29) 2009-11-25 doi:. ISSN 2013-2514. (Noiz kontsultatua: 2021-03-18).
- ↑ https://www.textoscientificos.com/quimica/fosforo/usos-fosfatos..
- ↑ a b (Ingelesez) «Phosphorus and eutrophication» Encyclopedia of the Environment 2017-08-02 (Noiz kontsultatua: 2021-03-18).
- ↑ (Ingelesez) Gnandi, K.; Tchangbedji, G.; Killi, K.; Baba, G.; Abbe, K.. (2006-03-01). «The Impact of Phosphate Mine Tailings on the Bioaccumulation of Heavy Metals in Marine Fish and Crustaceans from the Coastal Zone of Togo» Mine Water and the Environment 25 (1): 56–62. doi:. ISSN 1616-1068. (Noiz kontsultatua: 2021-03-18).